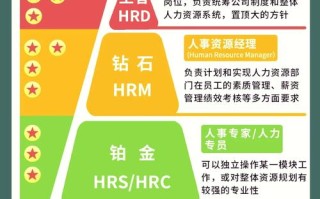
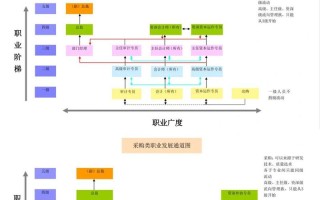
药品注册职业发展规划全景图
药品注册的职业发展可以看作是从“执行者”到“专家”,再到“管理者”和“战略家”的演进过程,整个职业生涯大致可以分为以下几个阶段:
第一阶段:入门与积累期 (0-3年)
这个阶段的核心目标是打好坚实的基础,熟悉基本流程,成为一名可靠的执行者。

典型岗位:
- 注册专员
- 注册助理
- CTA (Clinical Trial Associate - 临床试验申报相关)
核心职责:
- 资料整理与归档: 协助准备和整理申报资料,确保文件的完整性和准确性。
- 流程跟进: 跟踪药品注册申报(临床试验申请、IND、新药上市申请NDA、仿制药申请ANDA等)的进度,与内部研发、生产、临床等部门沟通协调。
- 信息检索: 学习使用国内外药品监管数据库(如FDA的CDER, EMA的EMA, NMPA的CDE官网),查询法规、指导原则和已获批产品的信息。
- 内部沟通: 作为注册部门与其他部门的联络人,传递信息,确保信息同步。
- 基础撰写: 在指导下撰写部分申报文件,如封面、目录、部分综述报告等。
所需技能与知识:
- 硬技能:
- 熟悉GMP、GCP等基本法规概念。
- 掌握Office办公软件(尤其是Excel和Word),有条件可学习专业的文档管理系统。
- 了解药品注册的基本流程和分类。
- 软技能:
- 极致的细心和耐心: 注册工作“失之毫厘,谬以千里”,细节决定成败。
- 优秀的沟通能力: 需要频繁与不同部门、不同背景的人员打交道。
- 强大的学习能力: 法规和指导原则更新快,需要持续学习。
- 抗压能力: 申报截止日期前的高强度工作压力是常态。
发展目标:
- 在1-2年内,能够独立负责一个或多个项目的资料准备和流程跟踪。
- 熟悉至少一个核心申报模块(如药学、非临床或临床)的资料要求。
- 建立起对药品注册全流程的宏观认识。
第二阶段:成长与深化期 (3-8年)
这个阶段的目标是成为某一领域的专家,能够独立负责复杂项目,并开始具备解决问题的能力。
典型岗位:
- 注册主管
- 高级注册专员
- 注册项目经理
核心职责:
- 独立负责项目: 作为主要联系人,独立负责一个或多个药品注册项目的全生命周期管理。
- 策略制定: 参与制定产品注册策略,包括剂型选择、规格设计、临床试验方案设计等。
- 资料撰写与审核: 主导撰写或深度参与关键申报文件(如CTD模块2、3),并审核下属或同事提交的资料。
- 法规解读与沟通: 深入解读复杂的法规和指导原则,与监管机构(如CDE)进行正式沟通(如Pre-会议会议、发补资料回应)。
- 跨部门领导: 在项目中领导一个小的跨职能团队,协调资源,解决冲突。
- 对外沟通: 代表公司与CDE、FDA等监管机构进行专业沟通。
所需技能与知识:

- 硬技能:
- 精通法规: 深入理解《药品注册管理办法》、M4指导原则等核心法规和技术要求。
- 模块化专业知识: 在药学、非临床或临床至少一个领域有深入的专业知识,能撰写和审核高质量的技术报告。
- 项目管理能力: 掌握基本的项目管理工具和方法,能制定计划、管理风险、控制预算和时间。
- 英文能力: 能够熟练阅读和撰写英文技术文件,是跨国注册工作的必备技能。
- 软技能:
- 战略思维: 能够从公司战略和产品市场前景的角度思考注册问题。
- 谈判与影响力: 在与内部团队或外部机构沟通时,能清晰表达观点,争取有利结果。
- 问题解决能力: 面对审评意见或突发问题,能快速找到解决方案。
发展目标:
- 成为公司内部公认的某一领域的注册专家(如“药学注册专家”、“临床注册专家”)。
- 成功主导至少一个复杂项目(如新药NDA/BLA、生物类似药申报)并获得批准。
- 建立起与监管机构的良好沟通渠道和口碑。
第三阶段:专家与领导期 (8年以上)
这个阶段的目标是成为行业内的资深专家或团队领导者,影响公司战略,培养新人。
典型岗位:
- 注册经理 / 高级经理
- 注册总监
- 首席注册官
- 法规事务总监/副总裁
- 独立顾问
核心职责:
- 战略决策: 制定公司整体或治疗领域的注册战略,决定研发管线和产品引进/授权。
- 团队管理: 领导和管理整个注册团队,负责招聘、培训、绩效考核和人才发展。
- 预算与资源管理: 负责注册部门的年度预算制定和资源分配。
- 高层沟通: 作为注册部门的代表,向公司高层(CEO, CSO等)汇报工作,提供决策支持。
- 行业影响: 参与行业协会工作,发表专业文章,对行业法规的制定产生影响。
- 危机管理: 处理重大的注册危机或突发事件。
所需技能与知识:
- 硬技能:
- 全局视野: 对公司研发、市场、商业策略有深刻理解,能将注册策略与商业成功紧密结合。
- 商业敏锐度: 具备成本效益分析、风险评估和投资回报分析的能力。
- 前沿洞察: 紧跟全球药品监管的最新动态(如AI在药物研发中的应用、真实世界数据RWE的使用等)。
- 软技能:
- 领导力: 能够激励团队,建立积极向上的部门文化。
- 商业谈判能力: 在对外合作(如License-in/out)中发挥关键作用。
- 公众演讲与表达能力: 能在重要会议、论坛上清晰阐述公司观点和战略。
- 情商与同理心: 处理复杂的人际关系和组织变革。
发展目标:
- 成为公司高层管理团队的核心成员之一。
- 建立一个高效、专业的注册团队,成为公司的核心竞争力。
- 在行业内建立个人品牌和影响力。
职业发展路径选择
除了上述的纵向晋升,药品注册人才还有几条横向发展的路径:
-
跨职能发展:
- 法规事务 → 医学事务/市场部: 注册人员对产品、法规和市场有深刻理解,可以转向医学事务(制定医学策略)或市场部(制定产品上市策略)。
- 法规事务 → 研发战略/项目管理: 对研发管线和法规路径的理解,使其非常适合参与公司的研发战略规划或大型研发项目管理。
-
行业领域深耕:
- 生物技术/细胞基因治疗: 这是当前最热门、最前沿的领域,对注册人员的要求极高,但职业回报和发展空间也最大。
- 创新药 vs. 仿制药: 创新药注册更侧重策略和科学沟通,仿制药注册更侧重效率和成本控制,可根据个人兴趣选择。
- 国际化: 专注于中国注册、美国注册或全球注册,成为国际注册专家。
-
自主创业/咨询:
在积累足够经验和人脉后,可以成立自己的咨询公司,为中小型药企提供注册外包服务。
行业趋势与未来展望
药品注册的未来发展将受到以下趋势的深刻影响,从业者需要提前布局:
- AI与大数据的应用: AI将用于法规信息检索、资料撰写辅助、审评预测等,注册人员需要拥抱技术,学会利用工具提高效率。
- 真实世界证据的应用: RWE在新药审批、适应症拓展、药物警戒等方面的作用越来越重要,注册人员需要掌握RWE的收集、分析和应用能力。
- 全球同步开发与注册: 随着研发全球化,中美欧等多国同步注册将成为常态,对注册人员的国际视野和跨文化沟通能力要求更高。
- 法规的持续更新: 特别是针对细胞和基因治疗等前沿领域,法规体系仍在不断完善,终身学习是注册人员的必备素质。
- 以患者为中心: 监管机构越来越重视患者的声音,患者报告结局等将成为注册资料的重要组成部分。
药品注册是一个“越老越吃香”的职业,它需要扎实的专业知识、严谨细致的工作态度和持续学习的能力,职业道路清晰,从专员到高管,每一步都充满了挑战和机遇,对于有志于投身此领域的人来说,建议:
- 打好基础: 入职初期,不厌其烦地做好每一件小事,这是建立专业信誉的开始。
- 选择赛道: 尽早确定自己感兴趣和擅长的领域(如药学、临床、生物药等)并深耕。
- 考取证书: 虽然没有强制性的准入证书,但RAC (Regulatory Affairs Certification) 等国际认证是专业能力的有力证明。
- 建立人脉: 积极参加行业会议,与同行、审评专家建立联系,信息和人脉是宝贵的财富。
药品注册是保障药品安全有效、造福患者的“守门人”角色,这份工作充满了成就感,希望这份规划能为您指明方向,祝您在药品注册的职业生涯中取得辉煌的成就!
版权声明:除非特别标注,否则均为本站原创文章,转载时请以链接形式注明文章出处。